理化学研究所 生命機能科学研究センター
超微形態研究チーム
更新日 2019年10月1日
米 村 研 究 室
Research
研究背景
生き物の形や動きがおもしろい
生き物にはいろいろな形のものがあります。体の中にはさまざまな器官、組織があります。さらに細胞の中にもオルガネラが秩序を持って配置していたり、細胞骨格が美しい構造を作っていることもあります。そして、生き物、特に動物は細胞レベルから個体レベルに至るまで、動くということが特徴です。私たちは電子顕微鏡レベルからの形態学的なバックグラウンドを持っており、動物の動的な秩序の形成に強く惹かれています。動的な秩序の形成などと言えば、分子からできている細胞がどのように分子の性質を利用しながら動的な秩序を生み出すのかという生命の本質にも関わることです。また、近年の再生医療への注目でもわかるように、同一の細胞が集まるだけでは器官としての機能は発揮されず、複数の種類の細胞が適切な形態形成を行って初めて器官として機能するようになるのですから、形態形成の仕組みがわかることは基礎から応用まで幅広く人々の期待に答えることになるでしょう。
どうやってそれが起こるのか?
さまざまな形態が見られること、動きがあることなどはかなりよく調べられてきています。最近ではゲノムが解読された種も多くなり、モデル生物の変異体の解析等からも形態形成に重要な役割をする遺伝子も多くわかってきていると言えるでしょう。しかし、遺伝子の関係が明らかになっただけでは、わかった気にならないのが私たちです。実際に細胞の中でどのようなことが起こっていて、ちょっとやそっとでは乱れない、秩序だった形態形成が起きるのか。それを明らかにするのが私たちの学問的な興味です。細胞から細胞集団のレベルでの実験を行って、アイデアを検証していきます。明解な結論を得るための巧妙な実験系をいかに組むことができるか、今までに知ることのできなかった重要な情報を得るためにどのように技術を導入したり開発するかということがとても重要で、研究者としてのセンスが常に試される研究分野です。
よく見ることから始めよう
私たちのバックグラウンドとして、光学顕微鏡、電子顕微鏡レベルの質の高い観察技術を有することがあります。これらの技術を当たり前に使用するという点、また経験に培われた細胞像の解釈を私たちのアプローチの中に最大限に生かすことが、私たちの研究のやり方の特色です。そして分子を根拠にする理解が必要であると考えているため、遺伝子発現、ノックダウンなどの手法のほか、タンパク質分子の性質を計測することも行います。積極的な共同研究で重要な分子についてはX線結晶解析により構造決定をします。その情報から戦略的な変異を導入して分子レベルの知見を深めます。さらに最近では力学的シグナルに着目し、その形態形成における数理的な理解も共同研究により始めています。
研究プロジェクト
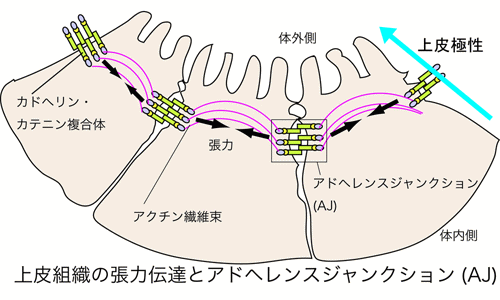
上皮細胞は、発生の最初に卵細胞が分裂して始めにできてくる細胞ですし、また、体を被い、表皮から消化管までさまざまな形態形成を行いながら、機能的な器官を作る中心的な細胞です。体を被うという性質から、生体外と生体内とを分ける基本的な役割を持ちます。同種の細胞が繋がってシートを作るにあたって、上皮細胞は細胞間接着装置を作ります。接着タンパクと細胞間を力学的に繋げるために細胞骨格との連結を担うタンパク作っているのがアドへレンスジャンクション(Adherens
junction, AJ)と呼ばれる細胞間接着装置です。上皮細胞では生体内の環境を維持するため、物質の輸送やそれを支えるタンパク、オルガネラの配置は偏っており、その偏りがあることを上皮極性と呼びます。
実験条件を自由に変え易い培養細胞を主な材料にして、できるだけシンプルな実験系から基本的に重要な問いに対する答えを得ようと考えています。そのためには、新たなアイデアによる実験系の確立や、技術開発などの創意工夫がとても重要です。培養細胞から器官形成、個体へとつながるES細胞には、大いに注目しています。
・現在のプロジェクト
αカテニンの張力感受性と多細胞形態形成における意義
上に述べた細胞間接着装置AJにはアクチン繊維が結合していることが知られています。アクチン繊維はミオシン繊維と相互作用して、モータータンパクミオシンIIの力を伝え、その結果、AJは細胞の内側から引っ張られることになります。AJには細胞接着分子カドヘリンがあり、細胞の外では隣接する細胞のカドヘリンと結合するため、AJを介して細胞内の収縮力が隣接する細胞に伝わります。それぞれの細胞でそのようなことが起こるので、一般に上皮細胞シートの中では隣り合う細胞はAJを介して引っ張りあっています。その明確な理由は明らかになっていませんが、私たちは、上皮細胞シートの維持そのものに重要であると考えています。強い力がかかって上皮シートが折れ曲がり、神経管等を作る場合はもちろん、AJによる力の適切な伝達が必要です(図1)。また、上皮シート内の細胞が死んで、上皮のバリア機能が落ちた場合には、細胞はすばやく、死細胞を除去するとともにその場所を隣接する細胞が異動することによって塞ぎます。このときも、極性のある上皮の場合は、AJを介して引っ張りあうことで(死細胞と生細胞の間では引っ張り合いは当然起こらず、死細胞に面している生細胞の間で引っ張り合いが強くなるということがわかっている)、損傷修復が起こるのです。このような場合、AJがその増加した収縮力に耐えられずに壊れてしまい、細胞が解離してしまっては全体の形態形成に繋がりません。また、それぞれの細胞の収縮力が完全に同一であるとは考えられず、多少の差がある場合、強い細胞が収縮し、周囲の細胞が引っ張られて伸びてしまうようでも、全体の形態形成に繋がりません。多少の差があっても、一人勝ちを起こさせないような、仕組みがあると好都合です。
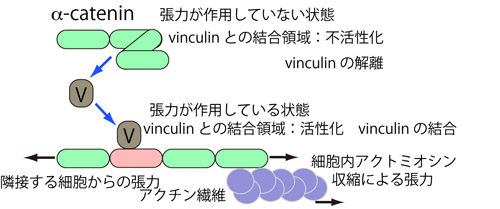
私たちはAJ内の主要なアクチン結合タンパクの一つビンキュリンがAJに力がかかる時は集積し、力がかからなくなると解離することを見いだしました(Miyake
et al. 2006)。強い力で引っ張られた時にはそれに対抗できるようにアクチン結合タンパクの量を増やして、より多くのアクチン繊維がAJに結合できるようにするという仕組みがあるかのようです。力が働かなくなるとビンキュリンは離れ、結合するアクチン繊維の量は減ると考えられます。収縮力の高い細胞が、隣接する細胞を引っ張りすぎて、AJが壊れる等した場合は、もう隣接する細胞が力を支えてくれないので、力がかからないことになり、ビンキュリンも離れ、細胞内の収縮力がAJに伝わらなくなります。これは一人勝ちしそうな細胞が、力を緩めて、隣接する細胞が引っ張り返すのを待つということだと考えられ、とてもうまくできたフィードバックの機構があるかのようです。
それは本当か、どのような仕組みなのか、それがわかって本当の理解になります。ビンキュリンがAJにやってくるのは、カドヘリンと複合体を作っているタンパクの一つα-カテニンが結合相手だからであることがすでにわかっていました。そこで、α-カテニン分子に力の程度を感知して、ビンキュリンに結合したりしなくなったりする仕組みがあるのでは?と考えました。いろいろと実験をしたところ、図2のように、α-カテニンにはビンキュリンに結合する領域に隣接して、その結合を邪魔する阻害領域があることがわかりました。その阻害が解けるのは、α-カテニンが引っ張られたときなのです。すなわちα-カテニンは張力感受性を持つAJタンパクで、その性質を使ってAJにも張力感受性(力がかかるとビンキュリンがやってきて強化する)生まれているわけです(Yonemura
et al., 2010)。
現在、進行中なのは、それではα-カテニンのどこがどうなって阻害ということが起こり、どうなってそれが解除されるのかを分子レベルで理解すること、また、都合の良い仕組みだと考えてきていますが、本当にどのくらい重要なのかを、特に上皮細胞の形態形成を例に検証したいということです。上皮細胞は二次元培養に限らず三次元培養も行い、正常なα-カテニンを発現する細胞と、張力感受性が異常なα-カテニンの変異体のみを発現する細胞での違いを見いだしてきています。構造生物学の専門家や数理科学の専門家と協力して理解を深め、将来的には張力感受性が形態形成に対して重要である場合を見極め、形態形成を操る技術の一つへ繋げたいと思います。一方、張力感受性がそれほど重要でない場面では何が重要であるのかという新しいテーマがあぶり出されてくると思われます。
αカテニンのアクチン結合性の調節機構とその意義
この上述したビンキュリン結合の張力感受性に関係するものの、少し違う性質を知ろうとしています。張力感受性を持つということはα-カテニンが引っ張られるからでありますが、そのN末ではカドヘリン-カテニン複合体を形成しますので、隣接する細胞から引っ張られます。一方、C末はアクチン繊維結合能があり、細胞内のアクチン繊維に引っ張られると考えられます。α-カテニンはカドヘリン-カテニン複合体を形成しているときは、生化学的にはアクチン繊維結合能が見られず、精製された単体ではアクチン繊維に結合することが報告されており、それからすると少なくともα-カテニンのアクチン繊維結合能は何らかの制御を受けていると考えられます。しかし、細胞内ではAJに張力感受性を示す、すなわち、カドヘリン-カテニン複合体内の引っ張られうるα-カテニンが存在していることも明らかです。ということは細胞内でも状況によりアクチン繊維結合能は上がったり下がったりしているように思われます。
以上のことから、アクチン繊維とα-カテニンとの結合の制御の仕組みも重要でおもしろいテーマだと考えられ、精力的に取り組んでいるところです。私は、α-カテニンとアクチン繊維との結合は自転車のギアとチェーンの関係の様に、一方方向に力をかける時には噛み合い、しっかり結合するが、力がかからない、あるいは異なる方向に力がかかる時には噛み合ず、結合が見られない、などの仕組みもあるのではないか、と想像しています(Yonemura
2011-a, Yonemura 2011-b)。
上皮細胞の極性形成機構
上皮細胞は二次元のシートを作るのが基本です。それが立体的に袋を作ったのが多細胞動物の原型です。このシートの意味は、生体外と区別して生体内という環境を作ることです。上皮シートの生体内側には基底膜という特殊な細胞外基質(ECM)成分からなる構造が接しています。上皮細胞の基底膜に接する細胞膜をbasal
membraneと呼び、その反対側、生体の外に面している細胞膜はapical membraneと呼びます。隣接する細胞と接している細胞膜はlateral
membraneです。Basal membraneとlateral membraneとは性質的にほとんど同じとも思われ、極性を考える上ではbasolateral
membraneと、しばしば一くくりにされます。栄養等を吸収する上皮細胞はapical membraneには栄養のトランスポーターなどが配置されています。この場合、Apical
membraneはその面積を大きくするために、微絨毛のようなアクチン繊維の束を軸とした特殊な細胞骨格に裏打ちされた形状を取っています。取り込まれた栄養は逆戻りせず、basal
membraneから放出されます。また、lateral membraneのapicalよりにはAJとさらにapicalよりに近接してtight
junction (TJ)があります。特にTJは細胞間の分子の移動(漏れ)を制御する構造です。上皮シートで覆われた区画の分子組成の違いを保つために、分子の通行を厳しく制限する場合もあります。これを上皮シートのバリア機能と言います。また、TJはむしろ特定の分子を選択的に通過させるチャンネルの役割を果たすこともあります。栄養を取り込むために必要なナトリウムイオンが生体外から、生体内に入ってしまうと、細胞はナトリウムポンプを使ってナトリウムをbasolateral側に汲み出します。そのままではapical側である管腔内のナトリウム濃度が下がり栄養が吸収できなくなるのでTJがナトリウムを選択的に透過させ、管腔側に戻します。このようにapical
membraneとbasolateral membraneとは分子組成も構造も機能も異なり、また細胞質でも輸送の方向性や細胞骨格の分布など分子、構造レベルの偏りがあります。これを上皮極性といいます。TJとAJとはちょうどapical
membraneとbasolateral membraneとの境界に形成され、TJの機能を考えても上皮極性と密接な関係があると考えられてきています。上皮極性は上に述べたように多細胞動物の体を作る上で本質的に大切なものであり、その破綻は上皮シートの機能の破綻につながり、細胞の分化やがん化とも関係しています。そのため上皮極性を作り、維持する機構は長い間注目を浴び続けています。関係のある遺伝子も多くわかってきましたが、それら相互の関係やapicalの勢力を広げる因子であるとか、basolateral
の勢力を広げる因子であるというような捉えられ方をしていて全体像はつかめていません。初めに何を頼りに、何が極性を決めるのか、また、決定した極性に従って実際の分子や構造の偏りをもたらすのはどんな仕組みによるのかなどは、整然と理解されていません。上皮極性は上皮がシートになった時に重要なのだから、細胞間接着と密接に関係があると長らく信じられてきましたが、この10年のあいだに、細胞間接着がなくてもここの上皮細胞は上皮極性を作りうる例がいくつも報告されてきました。TJなどの接着装置ができたことを、上皮極性ができた証拠とみなす研究者もまだ多いのですが、そう考えると、上皮極性に重要な因子も、接着装置形成だけに関わる因子も見分けがつかなくなります。そのようなことから、しっかりした全体像を把握するために細胞間接着を起こさず、しっかりした上皮極性を持つ培養細胞を使うという、工夫をした系を使って、上皮極性の機構を研究しています。
上皮細胞における隣接する細胞の生死を認識する機構
これもまた、非常に面白いけれどなかなか難しいテーマです。上皮シート内の細胞が死ぬとその細胞は押し出され、同時にその場所が周囲の細胞によって塞がれ、上皮シートのバリア機能の破綻が最短の時間になるように損傷修復が行われます。その際には死細胞を取り巻いている生細胞の死細胞に面した側にのみ、ミオシンIIの集積が見られます。そのミオシンIIはAJに結合したアクチン繊維と相互作用し、ミオシンIIの動きがAJを引っ張ることになります。ちょうど死細胞を取り巻いてアクトミオシンが断続的に形成され、それがAJによって繋がり一つの環を形成することになります。アクトミオシンの収縮によりその環は小さくなり、それが損傷修復を助けます。これがとても面白いのは、生細胞は隣の細胞が生きているか死んでいるかを素早く判断し、死んでいる細胞側にミオシンIIを集積させるということです。確かに、生きている細胞の周囲にミオシンIIを集積させ、生きている細胞を追い出してしまってはまずいし、そのようなことは起きません。上皮シートが健全に維持され、いざ破綻が起きれば、最速で修復を行う、その仕組みがここにあるはずです。最も肝心なのは、物質として何を感知して生と死とを見分けるのかということです。最近、これが重要だ、と報告をしている研究者もいるのですが、追試もできないので、私は必ずしも全面的には信じていません。しかしながら、それでは何なのか、というとなかなか突破口が開けない、そのようなテーマです。
これまでのプロジェクト
バナースペース
超微形態研究チーム
〒650-0047
兵庫県神戸市中央区港島南町2-2-3
TEL 078-306-3105
FAX 078-306-3107